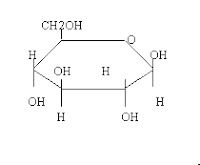
Alopiranosa
sábado, 22 de septiembre de 2007
lunes, 17 de septiembre de 2007
Disacaridos
Los disacáridos o azúcares dobles son un tipo de hidratos de carbono, o carbohidratos, formados por la unión de dos monosacáridos iguales o distintos mediante enlace O-glucosídico, mono o dicarbonílico, que además puede ser α o β en función del -OH hemiacetal. Los disacáridos más comunes son:
- Sacarosa: Formada por la unión de una glucosa y una fructosa. A la sacarosa se le llama también azúcar común.
- Lactosa: Formada por la unión de una glucosa y una galactosa. Es el azúcar de la leche.
- Maltosa, Isomaltosa, Trehalosa, Celobiosa: Formadas todas por la unión de dos glucosas, son diferentes dependiendo de la unión entre las glucosas.
La sacarosa
Es un disacárido formado por una molécula de glucosa y otra de fructosa.
Su nombre químico es :
- alfa-D-glucopiranosil(1->2)-beta-D-fructofuranósido.
Su fórmula química es:(C12H22O11)
Es un disacárido formado por la unión de una glucosa y una galactosa. A la lactosa se le llama también azúcar de la leche ya que aparece en la leche de las hembras de los mamíferos en una proporción del 4-5%. La leche de camella, por ejemplo, es rica en lactosa. Cristaliza con una molécula de agua de hidratación, con lo que su fórmula es: C12H22O11·H2O, luego se la puede también llamar lactosa monohidrato. Su peso molecular es 360,32 g/mol
La maltosa
Es un disacárido formado por dos glucosas unidas por un enlace glucosidico producido entre el oxigeno del primer carbon anomerico (proveniente de -OH) de una glucosa y el oxigeno perteneciente al cuarto carbon de la otra. Por ello este compuesto también se llama alfa glucopiranosil(1-4)alfa glucopiranosa
La isomaltosa
La isomaltosa es un azúcar doble (disacárido) formado por dos glucosas unidas por los grupos hidroxilo del carbono 1 en posición alfa de una glucosa y del carbono 6 de la otra glucosa. Por ello este compuesto también se llama alfa glucopiranosil(1-6)beta glucopiranosa. Al producirse dicha unión se desprende una molécula de agua y ambas glucosas quedan unidas mediante un oxígeno monocarbonílico que actúa como puente. La isomaltosa aparece en los granos de cebada germinada. Se puede obtener mediante la hidrólisis del almidón y Glucógeno. Su fórmula es C12H22O11.
La trehalosa
Es un azúcar doble (disacárido), formado de dos moléculas de glucosa donde la unión glicosidica involucra los grupos OH de los dos carbonos anoméricos. Partiendo de dos glucosas reductoras dulces se consigue un disacárido no reductor, con un bajo poder edulcorante. Al llegar al intestino la trehalosa se desdobla en glucosa por la acción de la enzima trehalasa. La ausencia de esta enzima provoca una enfermedad denominada Intolerancia a la trehalosa o intolerancia a los champiñones.
Está presente en la naturaleza en los champiñones, setas, y en la hemolinfa de insectos. Se está obteniendo a nivel industrial partiendo del almidón procedente de cereales, y se está usando en alimentos para deportistas y como agente de carga.
La Celobiosa
La celobiosa es un azúcar doble (disacárido) formado por dos glucosas unidas por los grupos hidroxilo del carbono 1 en posición beta de una glucosa y del carbono 4 de la otra glucosa. Por ello este compuesto también se llama beta glucopiranosil(1-4) glucopiranosa. Al producirse dicha unión se desprende una molécula de agua y ambas glucosas quedan unidas mediante un oxígeno monocarbonílico que actúa como puente. La celobiosa aparece en la hidrólisis de la celulosa. Su fórmula es C12H22O11.
Hecho por Omar el lunes, septiembre 17, 2007 1 blah blah-adas
lunes, 10 de septiembre de 2007
Ejercicos de la Ecuación Henderson-Hasselbalch
Si la aspirina tiene un pK de 3.5
se toma una cantidad igual para ambos casos de 250mg.
Estómago
[A-]=2.5mg
Intestino
[A-]= 79,056.9mg= 7.9x104
*Se absorve mas rápido en el Estómago porque al estar menos cargadas su absorción al torrente sanguíneo es mas rápido.
Hecho por Omar el lunes, septiembre 10, 2007 1 blah blah-adas
Ecuación de Henderson-Hasselbalch
La ecuación de Henderson-Hasselbalch se utiliza para calcular el pH de una solución buffer o tampón, a partir del pKa (la constante de disociación del ácido) y de las concentraciones de equilibrio del ácido o base, del acido o la base conjugada.
![pH = pK_a + \log_{10} \left ( \frac{[A^-]}{[AH]} \right )](http://upload.wikimedia.org/math/2/0/9/209dd541956373fc43b044253c264dac.png)
Derivación
Supongamos un ácido AH con disociación parcial. El equilibrio es:
y la constante de disociación asociada sera:
Despejando [H3O + ] de la constante de disociación:
Tomando logaritmos a ambos lados y aplicando la propiedad de los logaritmos para un producto se llega a:
E invirtiendo el cociente:
Hecho por Omar el lunes, septiembre 10, 2007 0 blah blah-adas
Acidos y Bases
Acidos
Según Arrhenius: Un ácido es una sustancia que libera un ión H+ en una solución acuosa.
Según Brönsted-Lowry: Sustancia quimica capaz de liberar un protón en un medio acuoso.
Según Lewis: Acepta un par de electrones e-.
Bases
Según Arrhenius: Una Base es una sustancia que libera un ión OH- en una solución acuosa.
Según Brönsted-Lowry: Sustancia quimica capaz de recibir un protón en un medio acuoso.
Según Lewis: Dona un par de electrones e-.
Hecho por Omar el lunes, septiembre 10, 2007 0 blah blah-adas
Molaridad, Molalidad y Normalidad
Molaridad
La molaridad (M) es el número de moles de soluto por litro de solucion . Por ejemplo, si se disuelven 0,5 moles de soluto en 100 mL de disolución, se tiene una concentración de ese soluto de 0,5 M (0,5 molar). Para preparar una disolución de esta concentración normalmente se disuelve primero el soluto en un volumen menor, por ejemplo 30 mL, y se traslada esa disolución a un matraz aforado, para después rellenarlo con más disolvente hasta los 100 mL.

Es el método más común de expresar la concentración en química sobre todo cuando se trabaja con reacciones químicas y relaciones estequiométricas. Sin embargo, tiene el inconveniente de que el volumen cambia con la temperatura.
Molalidad
La molalidad (m) es el número de moles de soluto por kilogramo de solvente. Para preparar soluciones de una determinada molalidad en un disolvente, no se emplea un matraz aforado como en el caso de la molaridad, sino que se puede hacer en un vaso de precipitados y pesando con una balanza analítica, previo peso del vaso vacío para poderle restar el correspondiente valor.

La principal ventaja de este método de medida respecto a la molaridad es que como el volumen de una disolución depende de la temperatura y de la presión, cuando éstas cambian, el volumen cambia con ellas. Gracias a que la molalidad no está en función del volumen, es independiente de la temperatura y la presión, y puede medirse con mayor precisión.
Es menos empleada que la molaridad.
Normalidad
La normalidad (N) es el número de equivalentes (n) de soluto (st) por litro de disolución (sc).
Normalidad ácido-base
Es la normalidad de una solución cuando se la utiliza para una reacción como ácido o base. Por esto suelen titularse utilizando indicadores de pH.
En este caso, los equivalentes pueden expresarse de la siguiente forma:
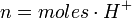 para un ácido, o
para un ácido, o  para una base.
para una base.
Donde:
- n: es la cantidad de equivalentes.
- moles: es la cantidad de moles.
- H+: Es la cantidad de protones cedidos por un mol del ácido.
- HO–: Es la cantidad de hidroxilos cedidos por un mol de la base.
Por esto, podemos decir lo siguiente:
 para un ácido, o
para un ácido, o  para una base.
para una base.
Donde:
- N: es la normalidad de la solución.
- M: es la molaridad de la solución.
- H+: Es la cantidad de protones cedidos por un mol del ácido.
- HO–: Es la cantidad de hidroxilos cedidos por un mol de la base.
Ejemplos:
- Una solución 1 M de HCl cede 1 M de H+, por lo tanto, es igual a 1 N.
- Una solución 1 M de Ca(OH)2 cede 2 M de HO–, por lo tanto, es igual a 2 N.
En este caso, los equivalentes pueden expresarse de la siguiente forma:
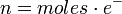 .
.
Donde:
- n: es la cantidad de equivalentes.
- moles: es la cantidad de moles.
- e–: Es la cantidad de electrones intercambiados en la hemireacción de oxidación o reducción.
Por esto, podemos decir lo siguiente:
 .
.
Donde:
- N: es la normalidad de la solución.
- M: es la molaridad de la solución.
- e–: Es la cantidad de electrones intercambiados en la hemireacción de oxidación o reducción.
Ejemplos:
- En el siguiente caso vemos que el anión nitrato en medio ácido (por ejemplo el ácido nítrico, puede actuar como oxidante, donde una solución 1 M, es 3 Nox.
- 4 H+ + NO3–1 + 3 e– ↔ NO + 2 H2O
- En el siguiente caso vemos que el anión ioduro, puede actuar como reductor, donde una solución 1 M, es 1 Nrd.
- 2 I– - 2 e– ↔ I2
- En el siguiente caso vemos que el catión argéntico, puede actuar como oxidante, donde una solución 1 M, es 1 Nox.
- 1 Ag+ + 1 e– ↔ Ag0
Hecho por Omar el lunes, septiembre 10, 2007 1 blah blah-adas
Puentes de Hidrogeno
El puente de hidrógeno es un enlace que se establece entre moléculas capaces de generar cargas parciales. El agua, es la sustancia en donde los puentes de hidrógeno son más efectivos, en su molécula, los electrones que intervienen en sus enlaces, están más cerca del oxígeno que de los hidrógenos y por esto se generan dos cargas parciales negativas en el extremo donde está el oxígeno y dos cargas parciales positivas en el extremo donde se encuentran los hidrógenos. La presencia de cargas parciales positivas y negativas hace que las moléculas de agua se comporten como imanes en los que las partes con carga parcial positiva atraen a las partes con cargas parciales negativas. De tal suerte que una sola molécula de agua puede unirse a otras 4 moléculas de agua a través de 4 puentes de hidrógeno. Esta característica es la que hace al agua un líquido muy especial.
Los puentes de Hidrógeno, se forman por átomos de Hidrógeno localizados entre átomos electronegativos. Cuando un átomo de Hidrógeno está unido covalentemente, a una átomo electronegativo, ej. Oxígeno o Nitrógeno, asume una densidad (d) de carga positiva, debido a la elevada electronegatividad del átomo vecino. Esta deficiencia parcial en electrones, hace a los átomos de Hidrógeno susceptibles de atracción por los electrones no compartidos en los átomos de Oxígeno o Nitrógeno
Obsérvese la configuración electrónica del Oxígeno:
8O 1s2 2s2 2pxêé pyé pzé
de ahí que
d+ d+
d-
d+ d+
d-
Figura: configuración electrónica del Oxígeno
el puente de Hidrógeno es relativamente débil entre -20 y -30 kJ mol-1, la fuerza de enlace aumenta al aumentar la electronegatividad y disminuye con el tamaño de los átomos participantes. Por tanto, el puente de Hidrógeno existe en numerosas moléculas no solo en el agua. Aquí solo se tratará lo referente al agua.
La estructura del agua favorece las interacciones para formar puentes de Hidrógeno, el arreglo siempre es perpendicular entre las moléculas participantes, además, es favorecido por que cada protón unido a un Oxígeno muy electronegativo encuentra un electrón no compartido con el que interactúa uno a uno. De lo anterior se concluye que cada átomo d Oxígeno en el agua interacciona con 4 protones, dos de ellos unidos covalentemente y dos a través de puentes de Hidrógeno.
colineales
Figura: Información sobre los puentes de Hidrógeno
Estudios de difracción de rayos X indican que la distancia entre los átomos de Oxígeno que intervienen en el puente de Hidrógeno, están separados por 0.28 nm lo que indica un arreglo tetraédrico de las moléculas de agua, además los puentes de Hidrógeno:
TETRAHEDRO
Figura: representación de una molécula tetraédrica del agua.
La colinealidad de los puentes es muy importante, un alejamiento de 10° ocasiona la que el puente se rompa.
Linnus Pauling postuló a partir de observaciones de las transiciones moleculares (i.e. el movimiento de los átomos con respecto a aquellos a los que están unidos) de los átomos participantes en la molécula D2O (el deuterio forma parte de la pléyade de Hidrógeno), que el puente de Hidrógeno es la interacción más importante que juega un papel crítico no solo en la estructura del agua sino en la estructura y función de las macromoléculas biológicas.
Hecho por Omar el lunes, septiembre 10, 2007 1 blah blah-adas














![K_{a} = \frac{[A^-][H_{3}O^+]}{[AH]}](http://upload.wikimedia.org/math/5/c/4/5c4cf2bd8148e55177b236322b9bd7e3.png)
![[H_{3}O^+] = \frac{K_{a}[AH]}{[A^-]}](http://upload.wikimedia.org/math/4/4/5/445f67a1657acb974dea7fd139406700.png)
![- \log_{10} \left ( [H_{3}O^+] \right ) = - \log_{10} \left ( K_{a} \right ) - \log_{10} \left ( \frac{[AH]}{[A^-]} \right )](http://upload.wikimedia.org/math/d/b/c/dbc1b42108dd6ae49d0aaef97aaa637b.png)
![pH = pK_{a} + \log_{10} \left ( \frac{[A^-]}{[AH]} \right )](http://upload.wikimedia.org/math/3/3/9/33901836dc6b8731ef86c4c40afc054b.png)

